| 首页 > 新闻资讯 > 如何将光学显微镜变成奈米显微镜 |
如何将光学显微镜变成奈米显微镜如何将光学显微镜变成奈米显微镜 发亮的分子越过了物理的屏障
然而,有一段很长的时间,光学显微镜被一个物理的屏障所阻碍,限制了所能解析的结构大小。在1873年,显微镜学家恩斯特?阿贝发表了一个方程式,证明了光学显微镜的解析度是如何受到光的波长,以及一些其它的因素所限制。因此这导致科学家们,在二十世纪的大半时间里,相信光学显微镜是永远无法用来观察那些比所用的光之波长的一半还小的物体,也就是0.2微米 (图一)。细胞里一些胞器的轮廓,例如细胞的发电机粒线体,虽可以看到,但是几乎不可能分辨更小的物体,因此譬如想要追踪细胞里蛋白质分子之间的相互作用,就无法做到,这好比能看到一个城市的建筑物,但却无法看出市民如何的生活,和如何为其生存而努力。为了了解一个细胞如何的运作,你必须能追踪个别的分子如何的工作。
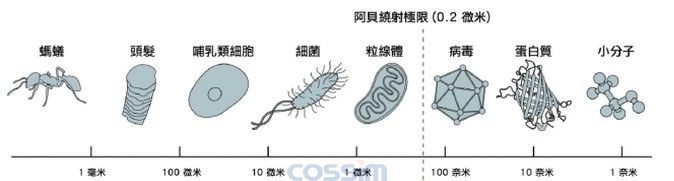 图解:图一 在十九世纪末叶,恩斯特?阿贝定义了光学显微镜的解析度约为光波长的一半,差不多是0.2微米,这意味着科学家能够区别一个完整的细胞以及一些细胞内的胞器,不过他们将永远无法分辨小到如一个正常大小的病毒,或是一个单一的蛋白质分子。
尽管阿贝的方程式依然成立,但绕射极限的障碍仍被克服了。艾瑞克?贝齐格,史蒂芬?海尔以及威廉?莫纳等三人之所以获得2014年的诺贝尔化学奖,就是因为他们利用萤光分子,将光学显微镜带进了另一个境界。理论上,不再存在有太小而无法观察的结构。就结果而言,光学显微镜变成了奈米显微镜。
如何规避阿贝绕射极限的故事,要分成两条路线来说;两个基于不同的原理所各自独立发展出的方法,都获得成功。让我们回溯到1993年,在芬兰西南部的一个学生公寓里,史蒂芬?海尔在翻阅一本量子光学的教科书时,得到了一个很棒的点子。
对阿贝绕射极限的青春叛逆面对的是怀疑
自从海尔在1990年从德国海德堡大学取得博士学位之后,他就一直在寻找方法,来规避阿贝在超过一个世纪以前所订下的限制。挑战一个已经建立的理论,这样的想法虽很诱人,但是在德国的资深科学家们,用怀疑面对了他的热情,导致了海尔往寒冷的北方寻找庇护所。一位在芬兰特尔库大学研究萤光显微镜术的教授,给了海尔在其研究小组工作的一个职位。海尔相信一定有一个机会能够克服阿贝的绕射极限,而当他读到那本量子光学课本里面“受激放射”的字语时,在他的脑海里浮现了一个新的想法:“在那个瞬间,曙光在我脑际出现,我终于找到一个实际的观念来追求 ― 一条真正的线索。”这是他于2009年自己的说明 ― 让我们进入他的想法一探究竟。
解答:用一个奈米大小的手电筒扫描样品
在特尔库大学,海尔在进行称为萤光显微镜术的研究,那是一种利用萤光分子来让细胞显像的技术。举例来说,他们可以使用只专一的与细胞的DNA偶合之萤光抗体,科学家们用一个短暂的脉冲光来激发抗体,这会让抗体发亮并持续一个短暂的时间,如果抗体是与DNA偶合的,它们就会在细胞当中放光,因为DNA是塞在细胞核里面的。利用这个方法,科学家们可以看到某些分子的位置,但是他们只能定出一群聚集在一起的分子之位置,例如一些纠缠在一起的多股DNA,但是因为解析度太低,而无法分辨单股的DNA,这就好像你可以看到一卷纱线,但却无法看出纱线是如何缠绕的。
当海尔读到受激放射时,他体认到应该可以设计一种奈米的手电筒,能够对着样品以一次一个奈米的方式扫描。利用受激放射,科学家们可以将分子的萤光淬灭,当他们将一道雷射光束照在那些发光的的分子上时,它们会立刻的失去能量而变暗。在1994年,海尔发表了一篇论文概略说明了他的想法,他规划的方法称为受激放射消去法,利用一道脉冲光将所有的萤光分子激发,同时利用另一道脉冲光将所有的萤光分子淬灭,但是只有在中间的一个奈米尺度大小的体积之内除外(图二),因此只会取得在这个体积之内的萤光。透过对样品的扫描以及同时对光线强度的测量,就可以取得一张清楚的图像。每一次被容许放出萤光的体积愈小,最后得到的影像解析度就愈高,因此在理论上,光学显微镜在解析度方面就不再有限制了。
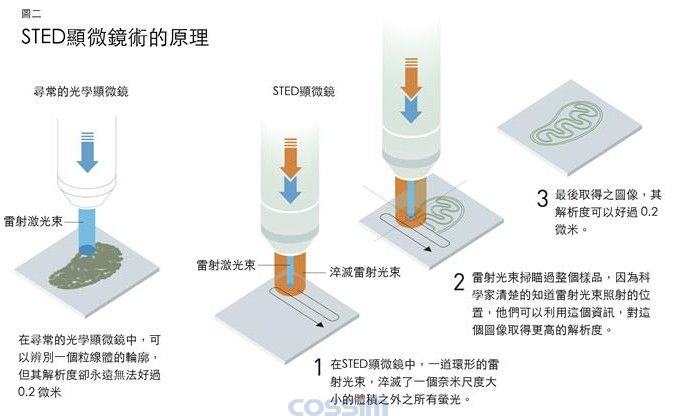 在德国发展头一个奈米手电筒
海尔的理论文章并未立刻的激起一场骚动,但是的确有趣到让海尔在位于哥廷根的马克斯?卜兰克生物物理化学研究所,得到一个职位。在接下来的数年里,他让自己的想法开花结果;他设计了一个STED显微镜,于2000年,已经能够展示真的可以实际的运用他的想法,其中之一是用来取得一张大肠杆菌的图像,并具有用光学显微镜从来无法达到的解析度(图三)。
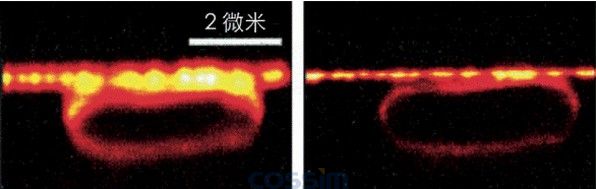 图解:图三 由史蒂芬?海尔透过STED显微镜,最先所取得的几个图像之一。在左边是一个普通的光学显微镜取得的大肠杆菌图像,在右边则是同一个大肠杆菌,用STED显微镜照出的结果,其解析度高了三倍。此图
STED显微镜从收集一大堆很小的体积所放出的光,然后集合成一张整体的图像,相对的比较,另一种原理也得到了成功,那被称为单分子显微镜术,需要将许多张图像重叠在一起。艾瑞克?贝齐格与威廉?莫纳各自独立的,以不同的基础观念切入,促成这项技术的发展。这项技术的基础,是在莫纳成功的观测到一个小的萤光分子时所奠定。
W. E. 莫纳 ― 首先观测到单一的萤光分子
在大部分的化学方法中,例如量测吸收和萤光,科学家们是同时观察上百万的分子,在这些实验中所得到的结果,反映的只是一种典型平均化的分子表现,但科学家们不得不接受这种困境,因为没有别的可能性。不过有很长的一段时间,他们梦想着能够量测每一个单一的分子,因为有愈丰富愈详尽的资讯,就愈可能去了解譬如疾病是如何的发展。
在1989年,莫纳成为全球第一位科学家能够量测单一分子对光的吸收,那是一项具有关键性的成就。当时他正在位于美国加州圣荷西的IBM研究中心工作,那个实验打开了一扇通往新未来的大门,并且启发了许多化学家将注意力转移到单分子的身上,其中之一就是艾瑞克?贝齐格,接着会在稍后说明他的成就。
八年之后,莫纳朝单分子显微镜迈出了第二步,那是运用之前诺贝尔奖在2008年所表彰过的绿色萤光蛋白质。
分子大小的灯一开一关
在1997年,莫纳进入了在加州大学的圣地牙哥分校,那正是后来获得诺贝尔桂冠的钱永健所在的学校,当时钱永健正尝试要让GFP放出像彩虹般的各种萤光。这个绿色萤光蛋白质是从一种萤光水母身上分离出来的,它的好处在于能让细胞里面的其它蛋白质显像。科学家们先利用基因科技,将绿色萤光蛋白质偶合到其它的蛋白质上,那绿色的萤光就会暴露出这个被标记的蛋白质位在何处。
莫纳发现有一种GFP可随意点亮或关掉,当他用488奈米波长的光去激发蛋白质的时候,蛋白质就开始发出萤光,但一个短暂的时间之后就会熄灭,在这之后无论他再用多强的光去照射这个蛋白质,它也不会发光,不过他后来发现当光的波长改为405奈米时,这个蛋白质就会恢复生机,当蛋白质重新活化后,它又会放出488奈米波长的萤光。
莫纳将这些可被激发的蛋白质均匀的散布在一个胶质内,让每个蛋白质之间的距离大于0.2微米的阿贝绕射极限,因为它们稀疏的散开来,一个普通的光学显微镜镜就可以区辨每一个发亮的分子 ― 它们就好像一堆具有开关的小灯泡,这项结果发表在1997年的“自然”期刊上。透过这个发现,莫纳展示了可以透过光学的方式,控制单一分子们的萤光,这解决了一个贝齐格在两年之前所想到的问题。
对学术感到疲乏 ― 但仍为阿贝的绕射极限而着迷
与海尔一样,贝齐格也为了越过阿贝绕射极限的想法而着迷。在1990年代初期,他正在美国纽泽西州的贝尔实验室,研究一种新的光学显微镜术,称为近场显微镜术。在此法中,光线是从一个非常薄的尖端所释出,这个尖端与样品之间的距离只有几个奈米,虽然这种显微镜术也可以克服阿贝绕射极限,但是此法具有一些主要的弱点,举例来说,因为放出的光范围太短,以至于无法看到细胞表面之下的结构。
贝齐格在1995年得到一个结论,那就是近场显微镜术无法更进一步的改善,此外他在学术界感觉不太自在,因此决定结束他的研究生涯;即便不知下一步要何去何从,他毅然辞职,但是阿贝绕射极限仍在他的心中。步行在一个寒冷的冬天里,他想到了一个新的点子;是否可能用具有不同性质的分子,那些发出不同颜色之萤光的分子,来克服阿贝绕射极限?
贝齐格已经能用近场显微镜术观测到单分子的萤光,与许多人一样,贝齐格受到莫纳的启发,他开始仔细考虑,如果使用几种会放出不同萤光的分子,例如红色、黄色和绿色,是否可以利用普通的光学显微镜得到相同的解析度。他的点子是让显微镜每一次用不同颜色的光来记录影像,如果同一种颜色的分子都是均匀的散布,而且相互之间的距离大于阿贝绕射极限的规范,它们的位置将可精确的决定。接着当这些影像重叠起来时,完整的图像将具有远超过阿贝绕射极限的解析度,红色、黄色和绿色的分子虽然相互的距离只不过几个奈米,但仍能区别,如此就能克服阿贝绕射极限。不过,仍有一些实际的困难,例如缺乏那些具有不同光学性质之分子,其差异要大到足以相互区别。在1995年,贝齐格在 Optical Letters 这份期刊上发表了上述想法之理论,随即离开了学术界,并进入了他父亲开的公司。
被绿色萤光蛋白质引诱回到显微镜术
贝齐格完全的脱离学术界,已经有许多年了,但是有一天,一个对科学的渴望突然又复苏了。回顾科学文献时,他第一次看到绿色萤光蛋白质的论文,体认到有一个蛋白质,能让其它的蛋白质在细胞内显像,活化了贝齐格对如何克服阿贝绕射极限的想法。
真正的突破发生在2005年,当时他偶然发现到那种可以随意活化的萤光蛋白质,很类似那些莫纳在1997年,于单分子的层次所观察到的萤光蛋白质。贝齐格知道,这个分子正是可以实现他在十年前所想到的那个主意,所需要的工具。这种萤光分子并不需要具有不同的颜色,它们还是可以在不同的时间发出萤光。
藉着影像的重叠超越阿贝绕射极限
只不过一年之后,与研究可激发萤光蛋白质的科学家合作,贝齐格展示了他的想法的确可以付诸实现。在一些例子当中,他们将会发光的蛋白质接在溶体的膜上面,溶体是细胞里的回收站,现在用一道脉冲光来激发出蛋白质的萤光,因为使用的脉冲很弱,所以只能让部分的分子开始发出萤光,由于它们的数目很少,几乎所有发光分子之间的距离均大于0.2微米的阿贝绕射极限,因此每一个发光的蛋白质之位置都可以在显微镜下记录。一会儿之后,当萤光消失时,他们重新激发另一组蛋白质,同样的,使用的脉冲弱到只能让部分的分子发出萤光,同时这一组图像被记录下来,这个步骤一直不断的重复。
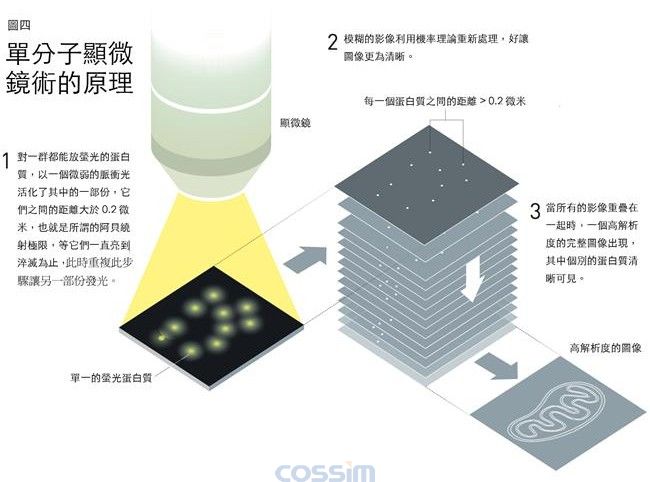 当贝齐格将所有的影像重叠起来时,得到了一张溶体膜的超高解析图像,它的解析度远远的超过了阿贝绕射极限。接着,贝齐格将这一份开创性的工作,于2006年发表在《科学》期刊上。
 图解:图五中间的图是溶体膜的图像,这是贝齐格用单分子显微镜,最初所取得的几个图像之一。在左边是相同的图,但是用传统的显微镜所取得的。在右边则是将膜的图像放大,请注意此图的尺度是0.2微米,等同于阿贝绕射极限,其解析度改进了许多倍。
这几位得奖者仍企图在描绘生命最深层的奥秘
这些由艾瑞克?贝齐格,史蒂芬?海尔以及威廉?莫纳等三人所开发的方法,发展出了几个现在为全世界各地所使用的奈米显微镜技术。这三位得奖者仍然活跃在这个不仅庞大,而且一直在增长的科学社群中,将创新的矛头对着奈米显微镜术的领域,当他们将功能强大的奈米显微镜瞄准在生命中最小的零件时,他们也同时取得了最尖端的知识。史蒂芬?海尔为了对脑突触有更好的了解,窥探了活的神经细胞内部;威廉?莫纳研究了与杭丁顿氏症(舞蹈症)有关的蛋白质;艾瑞克?贝齐格追踪了在胚胎中细胞的分裂,这些只是众多例子当中的几个。有一件事情是肯定的,2014年的诺贝尔化学桂冠得主们,对发展人类最重要的知识,已经奠定了基石。
文章出自:科信仪器 转载时必须以链接形式注明作者和原始出处及本声明。
|
| 首页 > 新闻资讯 > 如何将光学显微镜变成奈米显微镜 |